Tính Phi Kim Của Nguyên Tố Càng Mạnh Thì Sẽ Như Thế Nào?, hãy cùng hoc vn giải đáp trong bài viết dưới đây!
1. Tính Phi Kim Là Gì?
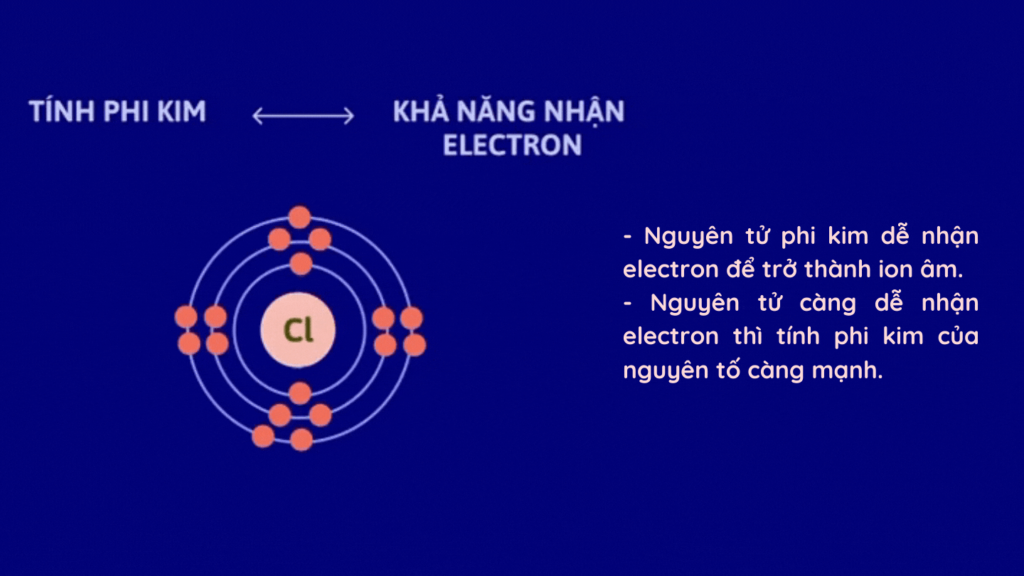
Tính phi kim là khả năng của một nguyên tố có thể nhận thêm electron trong quá trình tham gia phản ứng hóa học. Những nguyên tố có tính phi kim cao thường có xu hướng chiếm electron từ các nguyên tố khác trong phản ứng hóa học, tạo ra các liên kết ion hoặc cộng hóa trị. Điều này khiến chúng thể hiện tính chất hóa học khác biệt so với các nguyên tố kim loại.
1.1 Định nghĩa Tính Phi Kim
Tính phi kim phản ánh khả năng nhận electron của một nguyên tố. Các nguyên tố phi kim thường có năng lượng ion hóa cao và độ âm điện lớn, do đó chúng dễ dàng nhận electron để đạt trạng thái ổn định. Những nguyên tố này thường nằm ở phía phải của bảng tuần hoàn, bao gồm các nguyên tố thuộc nhóm Halogen, Oxy, và Nitơ.
1.2 Các yếu tố ảnh hưởng đến tính phi kim
Tính phi kim của một nguyên tố phụ thuộc vào nhiều yếu tố, bao gồm:
- Cấu trúc electron: Nguyên tử có lớp vỏ ngoài chưa đầy đủ electron thường có xu hướng nhận thêm electron để hoàn thiện cấu trúc vỏ ngoài, từ đó thể hiện tính phi kim mạnh.
- Số proton trong hạt nhân: Nguyên tố có nhiều proton hơn sẽ có lực hút điện tích mạnh hơn, giúp hút electron từ các nguyên tố khác.
- Vị trí trong bảng tuần hoàn: Các nguyên tố càng nằm về phía phải bảng tuần hoàn thường có tính phi kim mạnh do độ âm điện cao.
1.3 Mối quan hệ với tính chất hóa học của nguyên tố
Nguyên tố có tính phi kim cao thường có xu hướng phản ứng mạnh với kim loại, tạo ra các hợp chất ion hoặc cộng hóa trị. Chúng cũng có khả năng tham gia vào các phản ứng oxy hóa-khử, trong đó chúng đóng vai trò như chất oxy hóa mạnh.
2. Nguyên Tố Có Tính Phi Kim Cao
2.1 Ví dụ về các nguyên tố phi kim điển hình
Một số nguyên tố phi kim điển hình bao gồm:
- Nhóm nguyên tố Halogen: Bao gồm các nguyên tố như Flo, Clo, Brom, Iot, là những nguyên tố có tính phi kim cực mạnh.
- Nhóm khí hiếm: Dù phần lớn không tham gia phản ứng hóa học, các nguyên tố như Helium và Neon vẫn được coi là phi kim do chúng không có khả năng nhận electron.
2.2 Nguyên tố phi kim và tính chất hóa học
Các nguyên tố phi kim thường có khả năng phản ứng mạnh với các kim loại để tạo thành các hợp chất ion. Chẳng hạn, khi phản ứng với Natri (Na), Clo (Cl) sẽ tạo ra muối Natri Clorua (NaCl), một hợp chất ion phổ biến.
3. Ảnh Hưởng Của Yếu Tố Ngoại Cảnh Đến Tính Phi Kim
3.1 Ảnh hưởng của nhiệt độ
Tính phi kim của một nguyên tố có thể thay đổi dưới tác động của nhiệt độ. Nhiệt độ cao có thể làm giảm tính phi kim của nguyên tố do sự gia tăng khoảng cách giữa các electron và hạt nhân nguyên tử.
3.2 Ảnh hưởng của áp suất
Áp suất cao có thể làm tăng tính phi kim của các nguyên tố bằng cách nén các nguyên tử lại gần nhau, khiến lực hút electron giữa các nguyên tử trở nên mạnh hơn.
3.3 Tác động của các điều kiện môi trường
Môi trường xung quanh như độ ẩm và tính chất của dung môi cũng có thể ảnh hưởng đến tính phi kim của nguyên tố, đặc biệt là trong các phản ứng hóa học ở dạng dung dịch.
4. Ứng Dụng Thực Tế Của Tính Phi Kim
4.1 Tính phi kim trong công nghiệp
Tính phi kim có nhiều ứng dụng quan trọng trong công nghiệp:
- Sản xuất các hợp chất phi kim: Các nguyên tố như Oxy và Clo được sử dụng để sản xuất nhiều hợp chất công nghiệp như axit clohydric (HCl) và các chất khử trùng.
- Ứng dụng trong các quy trình hóa học: Nguyên tố phi kim như Flo được dùng trong sản xuất vật liệu Teflon và các hợp chất hữu cơ chứa Flo.
4.2 Ứng dụng trong đời sống
- Sử dụng trong sản xuất điện tử: Các nguyên tố phi kim như Silicon đóng vai trò quan trọng trong việc chế tạo các linh kiện bán dẫn.
- Vai trò trong ngành công nghệ sạch: Các nguyên tố như Oxy được sử dụng trong các quy trình lọc nước và khử trùng, đóng góp vào bảo vệ môi trường.
5. Mối Quan Hệ Giữa Tính Phi Kim Và Tính Phản Ứng
5.1 Tính phản ứng của phi kim trong các hợp chất hóa học
Nguyên tố có tính phi kim cao thường dễ dàng phản ứng với các kim loại, tạo ra các hợp chất ion. Ví dụ, Flo (F), nguyên tố có tính phi kim mạnh nhất, có thể phản ứng với hầu hết các kim loại để tạo thành hợp chất ion với khả năng tương tác hóa học mạnh mẽ.
5.2 Mối quan hệ giữa tính phi kim và tính axit-bazơ
Tính phi kim của nguyên tố cũng ảnh hưởng đến tính chất axit-bazơ của các hợp chất mà chúng tham gia. Các nguyên tố phi kim khi kết hợp với hidro tạo ra các axit mạnh như axit flohidric (HF) hoặc axit clohydric (HCl), thể hiện rõ tính chất của các axit này.
Kết luận
Tính phi kim của nguyên tố là một khái niệm quan trọng trong hóa học, phản ánh khả năng nhận electron của nguyên tố trong các phản ứng hóa học. Các nguyên tố có tính phi kim càng mạnh thì tính phản ứng càng lớn, đặc biệt là khi chúng kết hợp với kim loại hoặc trong các phản ứng oxy hóa-khử.
Tính Phi Kim Của Nguyên Tố Càng Mạnh Thì Sẽ Như Thế Nào? không chỉ giúp chúng ta nắm bắt được tính chất hóa học của các nguyên tố mà còn giúp ứng dụng chúng một cách hiệu quả trong công nghiệp và đời sống hàng ngày. Hocvn hy vọng với bài viết này sẽ luôn hữu ích trong cuộc sống và sự nghiệp của bạn.
Xem thêm:
[TÌM HIỂU] Phương Trình CH3COONa Điện Li