Giới thiệu về Axit Sunfurơ (H₂SO₃)
Axit sunfurơ, hay H₂SO₃, là một hợp chất không mấy xa lạ trong hóa học nhưng lại thường gây nhầm lẫn khi đánh giá độ mạnh yếu của nó. Rất nhiều người học thắc mắc: H2SO3 là chất điện li mạnh hay yếu?
Để trả lời chính xác, trước tiên chúng ta cần hiểu rõ H₂SO₃ là gì, nó hoạt động ra sao trong dung dịch nước, và tiêu chí nào dùng để phân biệt chất điện li mạnh với yếu.
H₂SO₃ là một axit yếu, lưỡng tính (có thể nhường 2 proton – gọi là axit hai nấc). Nó thường bị so sánh với H₂SO₄ (axit sunfuric), một axit mạnh nổi tiếng, nhưng hai chất này khác nhau rất nhiều về tính chất và mức độ phân li.
Tại sao ta nên quan tâm đến H₂SO₃? Ngoài vai trò trong học tập, hợp chất này còn có nhiều ứng dụng thực tiễn như khử clo trong nước, bảo quản thực phẩm và làm chất khử trong phản ứng hóa học.
Tìm hiểu về chất điện li
Chất điện li là gì?
Chất điện li là chất khi tan trong nước sẽ tạo ra dung dịch có khả năng dẫn điện nhờ sự xuất hiện của các ion.
Phân biệt chất điện li mạnh và yếu
- Chất điện li mạnh: Phân li hoàn toàn thành ion (ví dụ: HCl, NaCl).
- Chất điện li yếu: Chỉ phân li một phần (ví dụ: CH₃COOH, H₂CO₃).
Sự phân li trong nước
Khi H₂SO₃ tan trong nước, nó phân li từng bước (theo cân bằng thuận nghịch), điều này giúp chúng ta đánh giá rõ hơn về mức độ điện li.
Cấu trúc phân tử của H₂SO₃
Hình học phân tử và liên kết
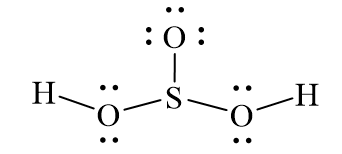
Phân tử H₂SO₃ gồm: 2 nguyên tử H, 3 O và 1 S. S liên kết với một O bằng liên kết đôi và hai nhóm –OH bằng liên kết đơn, tạo nên cấu trúc phân tử dạng gập.
So sánh với H₂SO₄
H₂SO₄ có 4 nguyên tử O, mạnh hơn rất nhiều vì cả hai H⁺ đều dễ tách ra. Trong khi đó, H₂SO₃ khó phân li hoàn toàn – yếu hơn đáng kể.
Sự phân li của H₂SO₃ trong nước
Phân li từng nấc
- H₂SO₃ ⇌ H⁺ + HSO₃⁻
- HSO₃⁻ ⇌ H⁺ + SO₃²⁻
Cả hai phản ứng đều là cân bằng thuận nghịch – nghĩa là không phân li hoàn toàn.
Giá trị hằng số Ka
- Ka₁ ≈ 1.5 × 10⁻²
- Ka₂ ≈ 6.4 × 10⁻⁸
Cả hai giá trị đều thấp → H₂SO₃ là axit yếu → chất điện li yếu.
Những yếu tố ảnh hưởng đến khả năng điện li
Độ tan và nồng độ
H₂SO₃ tan được trong nước nhưng không bền, dễ bị phân huỷ thành SO₂ và H₂O → làm giảm nồng độ ion trong dung dịch.
Ảnh hưởng của nhiệt độ và pH
Nhiệt độ cao có thể làm tăng sự phân li nhưng không đáng kể. Dung dịch có pH thấp sẽ ức chế sự phân li lần hai (HSO₃⁻ ⇌ H⁺ + SO₃²⁻).
H₂SO₃ là chất điện li mạnh hay yếu?
Quan sát thực nghiệm
Trong thí nghiệm dùng đèn kiểm tra độ dẫn điện, H₂SO₃ chỉ làm bóng đèn sáng yếu → chứng tỏ số ion tạo ra ít → điện li yếu.
Phân tích lý thuyết
Căn cứ vào giá trị Ka thấp, phân li từng phần và tính không bền, H₂SO₃ là chất điện li yếu.
So sánh với các axit khác
So sánh với HCl, H₂SO₄, HNO₃
- HCl: Điện li hoàn toàn → mạnh
- H₂SO₄: Nấc 1 mạnh, nấc 2 trung bình
- HNO₃: Mạnh
- H₂SO₃: Yếu ở cả hai nấc
So sánh với axit yếu khác (H₂CO₃)
H₂SO₃ và H₂CO₃ đều là axit yếu, hai nấc phân li → tính chất điện li tương tự nhau.
Ứng dụng thực tiễn của H₂SO₃
Trong công nghiệp thực phẩm
Dưới dạng SO₂, H₂SO₃ được dùng làm chất bảo quản trong rượu vang và trái cây sấy khô.
Xử lý nước
H₂SO₃ có khả năng khử clo dư trong nước, biến Cl₂ → Cl⁻, giúp làm nước an toàn hơn.
Vai trò của H₂SO₃ trong hóa học hữu cơ
Chất khử
H₂SO₃ có thể khử các nhóm chức aldehyde hoặc ketone, giúp tổng hợp các hợp chất hữu cơ mới.
Phản ứng với hợp chất hữu cơ
Nó có thể cộng vào liên kết đôi, phản ứng với nhóm carbonyl, giúp kiểm soát quá trình phản ứng.
Điều chế và bảo quản trong phòng thí nghiệm
Cách điều chế
Không thể mua sẵn H₂SO₃, mà phải điều chế bằng cách sục SO₂ vào nước.
Bảo quản và tính không bền
Dung dịch H₂SO₃ không bền, dễ phân hủy → phải dùng ngay sau khi điều chế.
Tác động môi trường và an toàn
Độc tính và nguy hiểm
Hít phải SO₂ (tiền chất của H₂SO₃) có thể gây kích ứng mắt, phổi và đường hô hấp.
Ảnh hưởng đến môi trường
H₂SO₃ trong nước mưa → gây mưa axit nhẹ, ảnh hưởng đến hệ sinh thái thủy sinh.
Những hiểu lầm phổ biến về H₂SO₃
Nhầm lẫn với H₂SO₄
Nhiều người cho rằng H₂SO₃ mạnh như H₂SO₄ – hoàn toàn sai!
Sai sót trong sách giáo khoa
Một số tài liệu cũ viết H₂SO₃ là chất điện li mạnh – điều này không chính xác theo các dữ liệu hiện đại.
Cách giảng dạy về chất điện li yếu
Chiến lược sư phạm
Dùng hình ảnh so sánh: chất điện li mạnh như loa mở to, chất yếu như âm thanh nhỏ.
Trình diễn thí nghiệm
Thử nghiệm độ dẫn điện với các loại axit → học sinh dễ hình dung hơn.
Thí nghiệm thực tế với H₂SO₃
Thí nghiệm độ dẫn điện
Cho dung dịch H₂SO₃ vào mạch đèn → đèn sáng yếu → xác nhận điện li yếu.
Dùng giấy quỳ và đo pH
Dung dịch có tính axit (quỳ hóa đỏ), nhưng pH không quá thấp → tính axit yếu.
Câu hỏi thường gặp
1. H2SO3 là chất điện li mạnh hay yếu?
Là chất điện li yếu vì phân li không hoàn toàn trong dung dịch nước.
2. Tại sao H₂SO₃ không ổn định?
Vì dễ phân hủy thành SO₂ và H₂O.
3. H₂SO₃ có dùng được trong bảo quản thực phẩm không?
Có, dưới dạng SO₂ – dùng trong rượu vang và trái cây sấy.
4. Làm sao để biết một axit là yếu hay mạnh?
Dựa vào giá trị Ka và khả năng dẫn điện của dung dịch.
5. H₂SO₃ có tự nhiên không?
Có, nó xuất hiện trong khí quyển sau khi SO₂ hòa tan vào nước mưa.
6. Ka và pKa khác nhau thế nào?
Ka là hằng số phân li axit; pKa = -log(Ka), giá trị càng thấp → axit càng mạnh.
Kết Luận
H₂SO₃, hay axit sunfurơ, là một chất điện li yếu với mức độ phân ly thấp trong nước. Điều này ảnh hưởng đến khả năng dẫn điện của dung dịch H₂SO₃ và làm cho nó trở thành một axit yếu. Tuy nhiên, H₂SO₃ có nhiều ứng dụng hữu ích trong công nghiệp và thực phẩm, đồng thời cũng có những tác động nhất định lên môi trường. Việc hiểu rõ về tính chất điện li của H₂SO₃ giúp chúng ta sử dụng nó một cách an toàn và hiệu quả hơn. Hi vọng hoc vn đã giúp các bạn giải đáp được câu hỏi H2SO3 Là Chất Điện Li Mạnh Hay Yếu?
Xem thêm:
[TÌM HIỂU] Phương Trình HNO2 Điện Li
[GIẢI ĐÁP] C5H13N Có Bao Nhiêu Amin Bậc 3?