Phản Ứng Hóa Học Giữa Fe và Cl₂
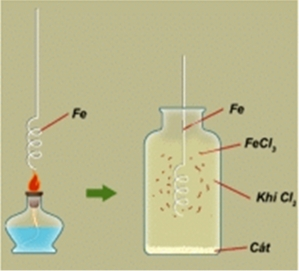
Phản ứng giữa sắt (Fe) và clo (Cl₂) là một ví dụ điển hình của phản ứng hóa học giữa một kim loại và một halogen. Khi clo dư được thêm vào sắt, phản ứng xảy ra trong điều kiện nhiệt độ cao tạo ra sản phẩm là các muối sắt (III) clorua (FeCl₃). Hãy cùng hocvn tìm hiểu Sản Phẩm Của Phản Ứng Hóa Học Hai Chất Fe Cl2 Dư này nhé!
Cơ Chế Phản Ứng
Quá trình phản ứng giữa Fe và Cl₂ diễn ra khi sắt nóng chảy hoặc bị nung nóng trong sự hiện diện của khí clo dư. Phản ứng này có thể biểu diễn qua phương trình hóa học:
2Fe + 3Cl₂ → 2FeCl₃
Phản ứng này chỉ diễn ra tốt nhất khi có đủ lượng clo dư, đảm bảo rằng tất cả các nguyên tử sắt đều được oxi hóa hoàn toàn thành sắt (III) clorua.
Các Yếu Tố Ảnh Hưởng Đến Phản Ứng
Một số yếu tố như nhiệt độ, áp suất, và nồng độ của các chất phản ứng có thể ảnh hưởng đến tốc độ và hiệu quả của phản ứng. Đặc biệt, nhiệt độ cao giúp tăng tốc độ phản ứng, trong khi việc duy trì nồng độ khí clo dư sẽ đảm bảo quá trình oxi hóa hoàn toàn của sắt.
Loại Sản Phẩm Tạo Ra
Trong phản ứng giữa Fe và Cl₂ dư, hai sản phẩm chính có thể được tạo thành là FeCl₂ và FeCl₃, phụ thuộc vào lượng clo tham gia phản ứng.
- FeCl₂: Hình thành khi clo không đủ dư để oxi hóa hoàn toàn sắt.
- FeCl₃: Là sản phẩm chính khi có clo dư. FeCl₃ là một muối sắt (III) clorua, có màu vàng nâu và dễ tan trong nước, tạo dung dịch có tính axit mạnh.
Tính Chất Của Sản Phẩm Phản Ứng
Tính Chất của FeCl₂
- Tính Chất Vật Lý: FeCl₂ có dạng tinh thể màu trắng hoặc xanh nhạt, dễ tan trong nước, tạo dung dịch có tính chất ion hóa mạnh.
- Tính Chất Hóa Học: Dễ bị oxi hóa trong không khí thành FeCl₃. Phản ứng với các bazơ mạnh như NaOH tạo thành kết tủa Fe(OH)₂.
Tính Chất của FeCl₃
- Tính Chất Vật Lý: FeCl₃ tồn tại ở dạng tinh thể màu vàng nâu, có độ tan cao trong nước. Nó tan hoàn toàn tạo dung dịch axit do thủy phân mạnh, sản phẩm thủy phân của FeCl₃ có tính ăn mòn.
- Tính Chất Hóa Học: Là một chất oxi hóa mạnh, FeCl₃ có thể phản ứng với nhiều chất khác nhau. Nó phản ứng với các kim loại, axit và bazơ để tạo ra các sản phẩm phụ khác nhau, như Cl₂ và Fe(OH)₃ khi phản ứng với nước.
So Sánh FeCl₂ và FeCl₃
- Tính Chất Vật Lý: FeCl₂ có màu xanh nhạt, trong khi FeCl₃ có màu vàng nâu.
- Tính Chất Hóa Học: FeCl₂ là chất khử, còn FeCl₃ là chất oxi hóa mạnh.
- Ứng Dụng: FeCl₂ chủ yếu được sử dụng trong ngành công nghiệp dược phẩm và sản xuất hóa chất, trong khi FeCl₃ được dùng rộng rãi trong công nghiệp thép, xử lý nước, và sát khuẩn.
Ứng Dụng Của Sản Phẩm Phản Ứng Trong Công Nghiệp và Đời Sống
Ứng Dụng của FeCl₂
- Công Nghiệp Dược Phẩm: FeCl₂ được sử dụng như một chất bổ sung sắt trong thuốc điều trị thiếu máu.
- Sản Xuất Hóa Chất: Là tiền chất quan trọng để sản xuất các hợp chất sắt khác.
- Xử Lý Nước: Được sử dụng trong các hệ thống lọc nước để loại bỏ các tạp chất và các kim loại nặng.
Ứng Dụng của FeCl₃
- Công Nghiệp Thép: FeCl₃ được sử dụng trong quá trình sản xuất thép để loại bỏ các tạp chất từ kim loại lỏng.
- Xử Lý Nước Thải: FeCl₃ giúp kết tủa các chất rắn lơ lửng trong nước, là một phần quan trọng trong các hệ thống xử lý nước thải công nghiệp.
- Hóa Chất Trong Phòng Thí Nghiệm: FeCl₃ được dùng làm chất xúc tác trong nhiều phản ứng hóa học hữu cơ và vô cơ.
- Sát Khuẩn: Với tính chất oxi hóa mạnh, FeCl₃ được sử dụng làm chất sát khuẩn và khử trùng.
Phân Tích Sâu Về Tính Chất FeCl₃
FeCl₃ có khả năng điện ly mạnh và dễ tan trong nước, tạo ra các ion Fe³⁺ và Cl⁻. Nó có khả năng oxi hóa các kim loại và hợp chất khác, khiến nó trở thành một chất oxi hóa mạnh trong nhiều phản ứng hóa học.
Các Chủ Đề Liên Quan
- So Sánh Với Các Sản Phẩm Khác Của Fe Với Halogen Khác: FeCl₃ có thể so sánh với các muối halogen khác của sắt như FeBr₃ và FeI₃. Mỗi muối có tính chất và ứng dụng khác nhau, phụ thuộc vào tính chất hóa học đặc thù của halogen.
- Phân Tích Phản Ứng Fe Với Các Halogen Khác: Không chỉ phản ứng với clo, sắt còn phản ứng với các halogen khác như brom (Br₂) và iốt (I₂) để tạo ra các sản phẩm tương ứng.
- Lịch Sử Sử Dụng FeCl₃ Trong Công Nghiệp: FeCl₃ đã được sử dụng rộng rãi trong lịch sử để xử lý nước và sản xuất thép. Vai trò của nó trong các ứng dụng công nghiệp đã được công nhận qua nhiều thập kỷ.
Kết Luận
Phản ứng giữa Fe và Cl₂ dư tạo ra các sản phẩm có giá trị và ứng dụng rộng rãi trong cả công nghiệp và đời sống. Việc hiểu rõ về tính chất, phản ứng, và ứng dụng của các sản phẩm này không chỉ giúp tăng cường kiến thức hóa học mà còn cung cấp cơ sở để áp dụng chúng vào thực tế.
Qua bài viết này hoc vn hy vọng bạn hiểu rõ hơn về Sản Phẩm Của Phản Ứng Hóa Học Hai Chất Fe Cl2 Dư để bạn mở rộng tư duy và khám phá thêm nhiều kiến thức mới.
Xem thêm:
[GIẢI ĐÁP] Đại Lượng Đặc Trưng Cho Khả Năng Hút e Là Gì?
[GIẢI ĐÁP] Có Bao Nhiêu Amino Axit Có Cùng CTPT C3H7O2N