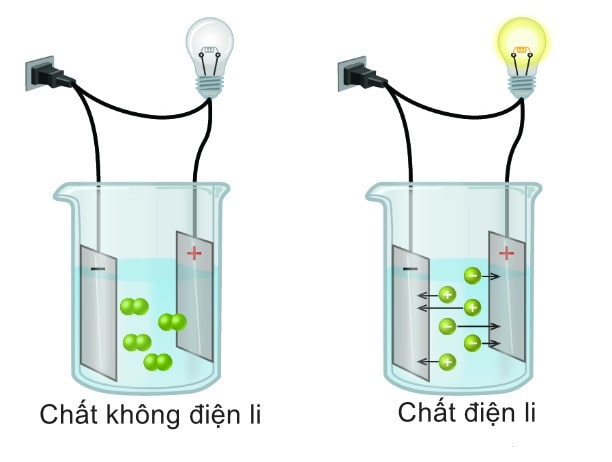
Chất điện li và chất không điện li là hai khái niệm cơ bản trong hóa học, thường được sử dụng để phân biệt các chất dựa trên khả năng phân ly thành ion và dẫn điện trong dung dịch nước. Trong khi chất điện li là những chất có khả năng phân ly ra ion và dẫn điện khi tan trong nước, chất không điện li lại có đặc tính ngược lại. Vậy chất nào không phải là chất điện li? Hãy cùng hocvn tìm hiểu chi tiết về chất không điện li qua chủ đề “Chất Nào Không Là Chất Điện Li?” nhé.
1. Khái niệm chất điện li và chất không điện li
Chất điện li là các chất khi tan trong nước sẽ phân ly thành ion, từ đó có khả năng dẫn điện. Ví dụ điển hình là muối ăn (NaCl), khi hòa tan trong nước sẽ phân ly thành các ion Na⁺ và Cl⁻, giúp dung dịch này dẫn điện.
Ngược lại, chất không điện li là những chất không phân ly ra ion khi tan trong nước, do đó không thể dẫn điện. Các chất không điện li thường là các hợp chất phân tử hoặc các chất hữu cơ không phân cực. Ví dụ điển hình của chất không điện li là đường (C₁₂H₂₂O₁₁), khi tan trong nước sẽ hòa tan mà không tạo ra bất kỳ ion nào, vì vậy dung dịch của nó không có khả năng dẫn điện.
2. Các ví dụ về chất không điện li
Hợp chất phân tử là một trong những loại chất không điện li phổ biến nhất. Khi các chất này tan trong nước, chúng chỉ hòa tan mà không phân ly thành ion. Một số ví dụ tiêu biểu bao gồm:
- Đường (C₁₂H₂₂O₁₁): Khi hòa tan trong nước, các phân tử đường vẫn giữ nguyên cấu trúc và không phân ly thành ion.
- Rượu etylic (C₂H₅OH): Dù có thể tan trong nước, nhưng nó không tạo ra ion dẫn điện.
- Nước cất (H₂O): Mặc dù nước là dung môi cho nhiều phản ứng điện ly, bản thân nước cất không phân ly ra đủ ion để dẫn điện mạnh.
Ngoài ra, nhiều chất hữu cơ cũng là chất không điện li, ví dụ như:
- Benzen (C₆H₆): Một chất lỏng không phân cực, không phân ly thành ion và không dẫn điện.
- Metan (CH₄): Khí metan là một hợp chất không phân cực, không ion hóa, và không dẫn điện trong điều kiện thông thường.
3. Phân loại chất không điện li
Chất không điện li có thể được phân loại theo nhiều dạng khác nhau, dựa trên trạng thái vật lý và tính chất phân cực của chúng. Một số loại phổ biến bao gồm:
- Chất rắn không tan trong nước: Hầu hết các chất hữu cơ, như sáp hoặc nhựa, không tan trong nước và cũng không phân ly thành ion. Vì vậy, chúng không phải là chất điện li.
- Chất lỏng không phân cực: Các chất lỏng như dầu mỏ và benzen không có tính phân cực cao, vì thế không thể phân ly thành ion trong dung dịch và không dẫn điện.
- Chất khí không ion hóa: Một số khí như nitơ (N₂), oxy (O₂), và khí cacbonic (CO₂) không phân ly thành ion trong nước, do đó chúng cũng không phải là chất điện li.
4. Sự khác biệt giữa chất điện li và chất không điện li
Chất điện li và chất không điện li khác nhau chủ yếu ở khả năng phân ly ra ion và dẫn điện. Cụ thể:
- Cấu trúc hóa học: Các chất điện li thường là các hợp chất ion (muối, axit, bazơ mạnh) hoặc có khả năng phân ly ra ion trong nước. Trong khi đó, chất không điện li thường là các hợp chất cộng hóa trị, liên kết giữa các nguyên tử được giữ chặt và không dễ phân ly thành ion.
- Khả năng phân ly ra ion: Chất điện li phân ly hoàn toàn hoặc một phần thành ion khi tan trong nước, còn chất không điện li không phân ly thành ion.
- Khả năng dẫn điện: Do chất điện li tạo ra ion, chúng có khả năng dẫn điện trong dung dịch nước. Trong khi đó, chất không điện li không tạo ra ion nên không thể dẫn điện.
5. Các yếu tố ảnh hưởng đến tính không điện li
Tính chất của chất không điện li phụ thuộc vào nhiều yếu tố khác nhau. Các yếu tố này bao gồm:
- Cấu trúc phân tử: Những chất có liên kết cộng hóa trị mạnh, đặc biệt là các hợp chất không phân cực, thường không phân ly thành ion và không là chất điện li. Ví dụ, các hợp chất như dầu mỏ hoặc sáp có liên kết cộng hóa trị và không phân cực.
- Tính chất của dung môi: Dung môi có ảnh hưởng lớn đến khả năng phân ly của các chất. Ví dụ, nước là một dung môi phân cực, nhưng các dung môi không phân cực như benzen không hỗ trợ sự phân ly của chất điện li.
- Nhiệt độ và áp suất: Trong một số trường hợp, nhiệt độ và áp suất cao có thể ảnh hưởng đến mức độ phân ly của chất, nhưng đa phần, các chất không điện li vẫn giữ nguyên tính chất của chúng ngay cả trong điều kiện này.
6. Ứng dụng của chất không điện li
Chất không điện li có nhiều ứng dụng trong đời sống và công nghiệp. Một số ví dụ điển hình bao gồm:
- Trong công nghiệp: Các chất như dầu mỏ và benzen được sử dụng làm dung môi trong các quy trình sản xuất hoặc làm nguyên liệu cho nhiều sản phẩm. Chúng không phân ly và không dẫn điện, do đó an toàn và ổn định hơn trong nhiều ứng dụng hóa học.
- Trong đời sống hàng ngày: Đường và rượu là những chất không điện li phổ biến trong cuộc sống hàng ngày. Chúng tan trong nước nhưng không dẫn điện, điều này rất quan trọng trong thực phẩm và đồ uống.
- Trong hóa học phân tích: Chất không điện li đóng vai trò quan trọng trong các quá trình phân tích hóa học. Việc phân biệt chất điện li và không điện li giúp các nhà hóa học xác định được tính chất của các chất và điều chỉnh các phương pháp phân tích phù hợp.
Kết luận
Thông qua chủ đề “Chất Nào Không Là Chất Điện Li?”, hoc vn và các bạn đã hiểu được chất không điện li là những chất không phân ly ra ion và không dẫn điện trong dung dịch nước. Các hợp chất phân tử, chất hữu cơ không phân cực, và nhiều loại khí không ion hóa đều thuộc nhóm chất không điện li. Sự khác biệt cơ bản giữa chất điện li và chất không điện li nằm ở khả năng phân ly và dẫn điện của chúng. Các chất không điện li có vai trò quan trọng trong nhiều ứng dụng thực tiễn, từ sản xuất công nghiệp đến hóa học phân tích. Hiểu rõ các yếu tố ảnh hưởng đến tính không điện li và ứng dụng của chúng sẽ giúp chúng ta khai thác tối đa tiềm năng của những chất này trong đời sống và khoa học.
Xem thêm:
[HƯỚNG DẪN] Phương Trình Hóa Học C6H12O6 Ag2O