Amoniac (NH₃) là một hợp chất hóa học phổ biến và có nhiều ứng dụng trong công nghiệp và đời sống hàng ngày. Khi hòa tan trong nước, NH₃ đóng vai trò như một bazơ, nhưng không giống như các bazơ mạnh như NaOH, NH₃ được coi là một bazơ yếu. Vậy để giải đáp câu hỏi Trong dung dịch NH₃ là một bazơ yếu vì sao? Hocvn sẽ phân tích chi tiết về cấu trúc, tính chất và quá trình phân ly của NH₃ để trả lời câu hỏi này.
1. Bản Chất Của NH₃ Trong Dung Dịch
1.1. Cấu Trúc Phân Tử NH₃
Phân tử NH₃ có cấu trúc hình học tam giác chóp, trong đó nguyên tử nitơ (N) nằm ở đỉnh và ba nguyên tử hydro (H) tạo thành đáy. Liên kết giữa N và H là liên kết cộng hóa trị, nhưng nguyên tử nitơ có cặp electron tự do, khiến NH₃ có khả năng nhận proton (H⁺), điều này giải thích vì sao NH₃ có tính bazơ.
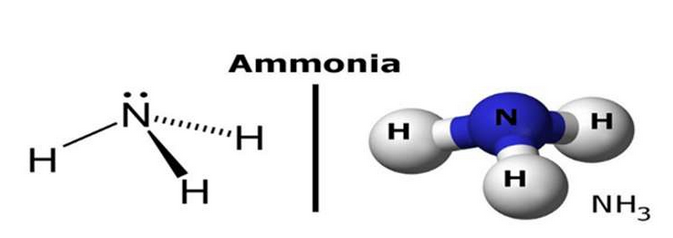
1.2. Tính Chất Hóa Học Của NH₃
Trong dung dịch nước, NH₃ có khả năng tương tác với các phân tử nước (H₂O) để nhận một proton, tạo thành ion NH₄⁺ (amoni) và ion OH⁻ (hydroxyl). Đây là phản ứng đặc trưng của một bazơ. Tuy nhiên, NH₃ không phân ly hoàn toàn mà chỉ tạo ra một lượng nhỏ ion OH⁻, điều này dẫn đến việc NH₃ được xếp vào nhóm bazơ yếu.
2. Quá Trình Phân Ly Của NH₃ Trong Dung Dịch
2.1. Phân Ly Không Hoàn Toàn
Khi NH₃ được hòa tan trong nước, chỉ một phần nhỏ các phân tử NH₃ thực sự phản ứng với nước để tạo thành ion NH₄⁺ và OH⁻. Phương trình phản ứng có thể được viết như sau:
NH₃+H₂O⇌NH₄⁺+OH⁻
Tuy nhiên, cân bằng này nằm rất gần về phía NH₃, nghĩa là phần lớn các phân tử NH₃ vẫn tồn tại dưới dạng không phân ly, chỉ một phần rất nhỏ bị phân ly thành NH₄⁺ và OH⁻.
2.2. Cân Bằng Hóa Học Trong Dung Dịch
Vì sự phân ly của NH₃ là không hoàn toàn, nên hằng số cân bằng bazơ (Kb) của NH₃ cũng có giá trị rất nhỏ. Điều này chỉ ra rằng khả năng nhận proton của NH₃ là yếu, và sự tồn tại của ion OH⁻ trong dung dịch NH₃ là rất thấp, điều này giải thích tại sao NH₃ có tính bazơ yếu.
3. Khái Niệm Bazơ Yếu
3.1. Định Nghĩa Bazơ Yếu
Bazơ yếu là những chất có khả năng nhận proton nhưng không phân ly hoàn toàn trong dung dịch. Tính bazơ yếu của NH₃ xuất phát từ khả năng nhận proton của nó, nhưng mức độ phản ứng với nước để tạo OH⁻ lại rất hạn chế. Điều này khác với bazơ mạnh như NaOH, khi tan trong nước, sẽ phân ly hoàn toàn và tạo ra một lượng lớn ion OH⁻.
3.2. So Sánh Với Bazơ Mạnh
Các bazơ mạnh như NaOH hoặc KOH có khả năng phân ly hoàn toàn trong nước, tạo ra lượng lớn OH⁻, khiến dung dịch có tính bazơ mạnh. Ngược lại, NH₃ chỉ phân ly một phần rất nhỏ, dẫn đến tính bazơ yếu.
4. Tại Sao NH₃ Là Bazơ Yếu?
4.1. Khả Năng Nhận Proton Yếu
Khả năng của NH₃ trong việc nhận proton yếu hơn so với các bazơ mạnh. Điều này là do cặp electron tự do trên nguyên tử nitơ trong NH₃ không dễ dàng bị sử dụng để liên kết với proton như các bazơ mạnh khác. Sự tương tác giữa NH₃ và nước yếu hơn, dẫn đến việc NH₃ không thể tạo ra đủ ion OH⁻ để trở thành một bazơ mạnh.
4.2. Sự Tương Tác Với Nước
Trong dung dịch, sự tương tác của NH₃ với nước diễn ra nhưng không hiệu quả như các bazơ mạnh khác. Mặc dù NH₃ có thể nhận proton từ nước, nhưng quá trình này xảy ra chậm và không triệt để. Điều này dẫn đến việc NH₃ chỉ tạo ra một lượng nhỏ OH⁻ trong dung dịch, khiến dung dịch NH₃ có tính bazơ yếu.
5. Ứng Dụng Thực Tiễn Của NH₃ Là Bazơ Yếu
5.1. Trong Công Nghiệp
NH₃ được sử dụng rộng rãi trong công nghiệp, đặc biệt là trong sản xuất phân bón và các hợp chất amoni khác. Mặc dù NH₃ là một bazơ yếu, tính chất này phù hợp cho nhiều ứng dụng mà việc duy trì môi trường bazơ yếu là cần thiết, chẳng hạn như trong quá trình xử lý nước thải.
5.2. Trong Phòng Thí Nghiệm
Trong các thí nghiệm hóa học, NH₃ thường được sử dụng làm dung dịch tạo môi trường bazơ yếu để tránh những phản ứng quá mạnh gây ảnh hưởng đến kết quả. Điều này đặc biệt hữu ích trong các phản ứng hữu cơ và hóa phân tích, nơi việc kiểm soát mức độ bazơ là quan trọng.
6. Tính Chất Vật Lý Và Phương Trình Ion Của NH₃ Trong Nước
6.1. Tính Chất Vật Lý Của NH₃
NH₃ là một chất khí có mùi hăng đặc trưng và tan tốt trong nước. Khi hòa tan, NH₃ không chỉ tạo ra dung dịch có tính bazơ yếu mà còn có thể tham gia vào nhiều phản ứng hóa học khác nhau.

6.2. Phương Trình Ion Của NH₃ Trong Nước
Phương trình phản ứng của NH₃ trong nước như sau:
NH₃+H₂O⇌NH₄⁺+OH⁻
Hằng số cân bằng Kb cho phản ứng này là khá nhỏ, điều này phản ánh tính bazơ yếu của NH₃ trong dung dịch nước.
Kết Luận
Dung dịch NH₃ là một bazơ yếu do quá trình phân ly không hoàn toàn của NH₃ trong nước và khả năng nhận proton yếu của nó. Mặc dù NH₃ có thể tạo ra OH⁻ trong dung dịch, nhưng lượng ion này rất nhỏ, làm cho NH₃ chỉ có tính bazơ yếu. Tuy nhiên, NH₃ vẫn đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và nghiên cứu, từ sản xuất phân bón đến xử lý nước thải và các thí nghiệm hóa học. Việc hiểu rõ tính chất bazơ yếu của NH₃ không chỉ giúp nắm vững kiến thức hóa học mà còn ứng dụng hiệu quả trong thực tế. Hoc vn đã giúp các bạn giải thích được vấn đề Trong dung dịch NH₃ là một bazơ yếu vì sao?. Chúc các bạn học tốt!
Xem thêm:
[TÌM HIỂU] Phản Ứng Hóa Học S H2SO4 Đặc Nóng
[TÌM HIỂU] Phương Trình Phản Ứng NH4HCO3 Ba OH 2