Ethanol, hay còn được gọi là rượu etylic (C2H5OH), là một hợp chất hữu cơ phổ biến và có mặt trong nhiều lĩnh vực như công nghiệp, thực phẩm, và hóa học. Một câu hỏi thường gặp khi nghiên cứu về C2H5OH là: “C2H5OH có dẫn điện không?” Để trả lời câu hỏi này, cùng Hocvn tìm hiểu về cấu trúc, tính chất của C2H5OH, và các yếu tố ảnh hưởng đến khả năng dẫn điện của nó.
Định Nghĩa và Tính Chất Của C2H5OH
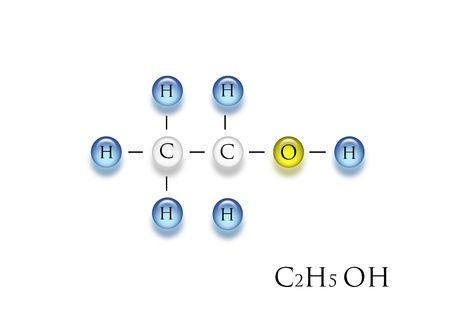
Định nghĩa C2H5OH (Ethanol)
C2H5OH, hay ethanol, là một hợp chất hữu cơ thuộc nhóm alcohol. Nó bao gồm hai nguyên tử cacbon (C), sáu nguyên tử hydro (H) và một nhóm hydroxyl (-OH). Ethanol là một chất lỏng không màu, có mùi đặc trưng, và dễ cháy. Đây là thành phần chính trong các loại đồ uống có cồn như bia, rượu vang và rượu mạnh.
Công thức cấu tạo và phân tử khối
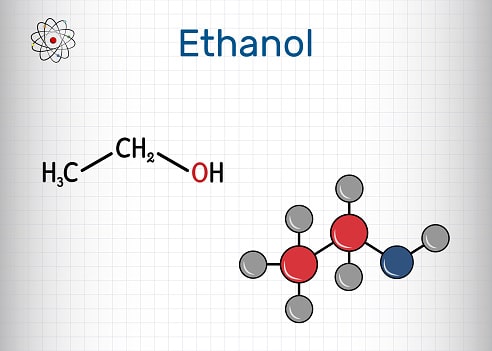
Công thức phân tử của ethanol là C2H5OH, với cấu trúc hóa học gồm một nhóm etyl (C2H5-) liên kết với một nhóm hydroxyl (-OH). Phân tử khối của ethanol là khoảng 46 g/mol.
Tính chất vật lý và hóa học
- Trạng thái và màu sắc: Ethanol tồn tại dưới dạng lỏng ở nhiệt độ phòng, không màu và có mùi thơm nhẹ.
- Tính hòa tan trong nước: Ethanol tan hoàn toàn trong nước, do khả năng tạo liên kết hydro giữa các phân tử nước và nhóm hydroxyl (-OH) của ethanol.
- Tính dễ bay hơi và cháy: Ethanol rất dễ bay hơi và dễ cháy, tạo ra ngọn lửa màu xanh đặc trưng khi cháy trong không khí.
Khả Năng Dẫn Điện Của C2H5OH
Khái niệm về dẫn điện
Để một chất có khả năng dẫn điện, nó cần chứa các hạt mang điện (ion hoặc electron) có khả năng di chuyển tự do. Các chất rắn như kim loại dẫn điện nhờ các electron tự do, trong khi các chất lỏng như dung dịch muối hoặc axit dẫn điện nhờ sự có mặt của các ion.
Điều kiện để một chất dẫn điện
- Sự có mặt của ion tự do: Một chất lỏng hoặc dung dịch dẫn điện khi trong đó có chứa các ion tự do. Các ion này có thể di chuyển dưới tác dụng của điện trường, tạo ra dòng điện.
- Khả năng phân ly trong dung dịch: Các chất điện ly (như axit, bazơ và muối) khi hòa tan trong nước sẽ phân ly thành các ion, giúp dung dịch dẫn điện.
C2H5OH trong nước (không phân ly tạo ion)
Ethanol (C2H5OH) là một hợp chất hữu cơ không phân ly thành ion khi hòa tan trong nước. Dù ethanol có thể tạo liên kết hydro với nước và hòa tan hoàn toàn, nhưng nó không tách ra thành các ion tự do. Do đó, ethanol không có khả năng dẫn điện trong dung dịch nước hay trong dạng nguyên chất.
Kết luận về khả năng dẫn điện của C2H5OH
Vì không phân ly thành ion, ethanol không có khả năng dẫn điện. Điều này làm cho C2H5OH trở thành một dung môi hữu cơ không dẫn điện, thích hợp cho nhiều ứng dụng trong hóa học và công nghiệp.
So Sánh C2H5OH Với Các Chất Khác
So sánh với nước (H2O)
- Nước tinh khiết: Nước tinh khiết dẫn điện rất yếu vì nó chỉ chứa một lượng rất nhỏ ion H⁺ và OH⁻.
- Nước muối: Nước muối dẫn điện mạnh vì các phân tử muối (NaCl) phân ly thành ion Na⁺ và Cl⁻ trong nước.
So sánh với các dung dịch axit, bazơ
- Dung dịch axit (HCl): HCl trong nước phân ly hoàn toàn thành ion H⁺ và Cl⁻, dẫn điện mạnh.
- Dung dịch bazơ (NaOH): NaOH trong nước phân ly thành ion Na⁺ và OH⁻, cũng dẫn điện mạnh.
So sánh với các dung môi hữu cơ khác (Methanol, Propanol)
- Methanol (CH3OH) và Propanol (C3H7OH): Tương tự ethanol, các dung môi hữu cơ như methanol và propanol không phân ly thành ion trong nước, do đó cũng không dẫn điện.
Ứng Dụng Thực Tiễn Liên Quan Đến Khả Năng Dẫn Điện Của C2H5OH
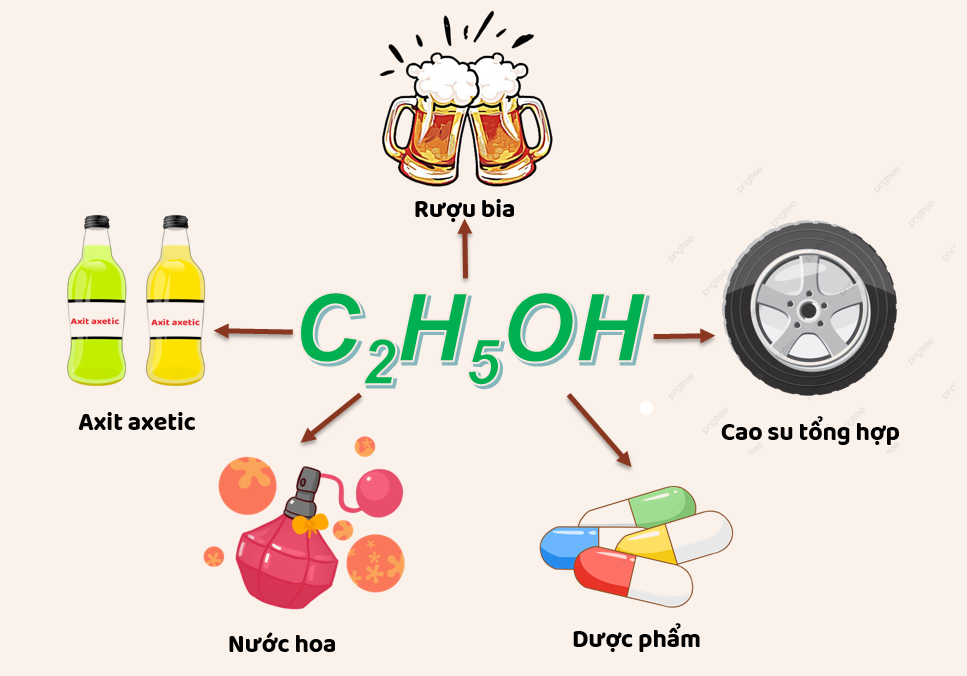
Trong công nghiệp thực phẩm và đồ uống
Ethanol được sử dụng rộng rãi trong công nghiệp thực phẩm và đồ uống như một thành phần chính trong các loại đồ uống có cồn. Khả năng không dẫn điện của ethanol đảm bảo tính an toàn trong nhiều quá trình sản xuất và bảo quản.
Trong công nghiệp hóa chất
Trong ngành công nghiệp hóa chất, ethanol được sử dụng làm dung môi để pha loãng và hòa tan các chất khác mà không ảnh hưởng đến tính chất điện hóa của các chất này. Do không dẫn điện, ethanol thường được dùng trong các quy trình cần kiểm soát điện tích.
Trong nghiên cứu và phân tích hóa học
Ethanol là một dung môi phổ biến trong phòng thí nghiệm do khả năng hòa tan tốt nhiều chất và không dẫn điện. Điều này giúp ethanol trở thành lựa chọn lý tưởng trong nhiều phản ứng và quy trình phân tích hóa học.
Các Thí Nghiệm Minh Họa Khả Năng Dẫn Điện Của C2H5OH
Thí nghiệm so sánh với nước và dung dịch muối
Một thí nghiệm đơn giản có thể được thực hiện để so sánh khả năng dẫn điện của ethanol với nước và dung dịch muối. Khi đặt các điện cực vào các dung dịch, ta sẽ thấy rằng dung dịch muối dẫn điện mạnh, nước dẫn điện rất yếu, và ethanol không dẫn điện.
Thí nghiệm so sánh với dung dịch axit và bazơ
Khi thử với dung dịch axit (HCl) hoặc bazơ (NaOH), ta sẽ nhận thấy rằng các dung dịch này dẫn điện mạnh nhờ sự phân ly ion, trong khi ethanol không tạo ra sự dẫn điện.
Quan sát và giải thích kết quả
Qua các thí nghiệm trên, ta có thể kết luận rằng C2H5OH không dẫn điện do không có sự hiện diện của các ion tự do, khác biệt so với các dung dịch điện ly như axit, bazơ, và muối.
Kết Luận
C2H5OH (ethanol) là một dung môi hữu cơ không dẫn điện vì không phân ly thành ion trong nước. Tính chất này làm cho ethanol trở thành một chất hữu ích trong nhiều ứng dụng công nghiệp và khoa học, nơi mà sự không dẫn điện là cần thiết. Ethanol cũng được sử dụng rộng rãi trong các ngành công nghiệp thực phẩm, đồ uống, hóa chất và trong nghiên cứu khoa học do tính an toàn và khả năng hòa tan tuyệt vời của nó.
Hocvn chúc bạn học tập tốt!
Xem thêm:
[GIẢI ĐÁP] CH3COONH4 Là Chất Điện Li Mạnh Hay Yếu?
[HƯỚNG DẪN] Bài Tập Về Phản Ứng Giữa Fe Dư HNO3